時間:2020-01-10| 作者:Admin
β-地中海貧血癥是一組遺傳性溶血性貧血,其共同特點是由于珠蛋白基因的缺陷使血紅蛋白中的珠蛋白肽鏈有一種或幾種合成減少或不能合成。導致血紅蛋白的組成成分改變,本組疾病的臨床癥狀輕重不一,大多表現為慢性進行性溶血性貧血。
2019年1月7號,華東師范大學李大力、劉明耀及廣西醫科大學賴永榕共同通訊在Cell Research上在線發表了題為Reactivation of γ-globin expression through Cas9 or base editor to treat β-hemoglobinopathies 的研究論文,該研究利用Cas9:sgRNA RNP的電穿孔來編輯造血干/祖細胞(HSPC)中的HBG1/2啟動子,成功地在β地中海貧血患者衍生的HSPC中達到了85%的平均編輯效率,導致γ-珠蛋白mRNA表達增加(相對于α-珠蛋白的表達率高達126%),并提高了終末紅系分化率。重要的是,研究還發現BCL11A結合位點(T GCCA:-114至-119)是抑制γ-珠蛋白的關鍵,是堿基編輯器hA3A-BE3誘導HBG表達突變和升高的理想靶點。

β-血紅蛋白基因的突變是成人血紅蛋白(HbA;α2β2)的重要組成部分,其結果要么是產生異常的鐮狀血紅蛋白導致鐮狀細胞病,要么是β-血紅蛋白合成不足導致β-地中海貧血。這兩種主要形式的β血紅蛋白病導致紅細胞生成受損和危及生命的貧血。臨床證據表明,重新激活通常在出生后因某些基因突變而沉默的胎兒γ-珠蛋白(HB G)基因表達可以改善β-血紅蛋白病的臨床過程。在β地中海貧血中,升高的胎兒γ-珠蛋白水平與α-珠蛋白相互作用形成胎兒血紅蛋白(HbF;α2-γ2),使α/β樣珠蛋白比例恢復,在SCD中,γ-珠蛋白減少HBS聚合。再激活HB G表達有兩種主要策略:降低HB G1/2啟動子區域關鍵反式作用抑制因子(如BCL11A)的表達或抑制順式調節元件的缺失。
為了制定臨床實施的實用策略,研究人員利用Cas9:sgRNA RNP的電穿孔來編輯造血干/祖細胞(HSPC)中的HBG1/2啟動子。研究成功地在β地中海貧血患者衍生的HSPC中達到了85%的平均編輯效率,導致γ-珠蛋白mRNA表達增加(相對于α-珠蛋白的表達率高達126%),并提高了終末紅系分化率。重要的是,研究還發現BCL11A結合位點(TGCCA:-114至-119)是抑制γ-珠蛋白的關鍵,是堿基編輯器hA3A-BE3誘導HB G表達突變和升高的理想靶點。
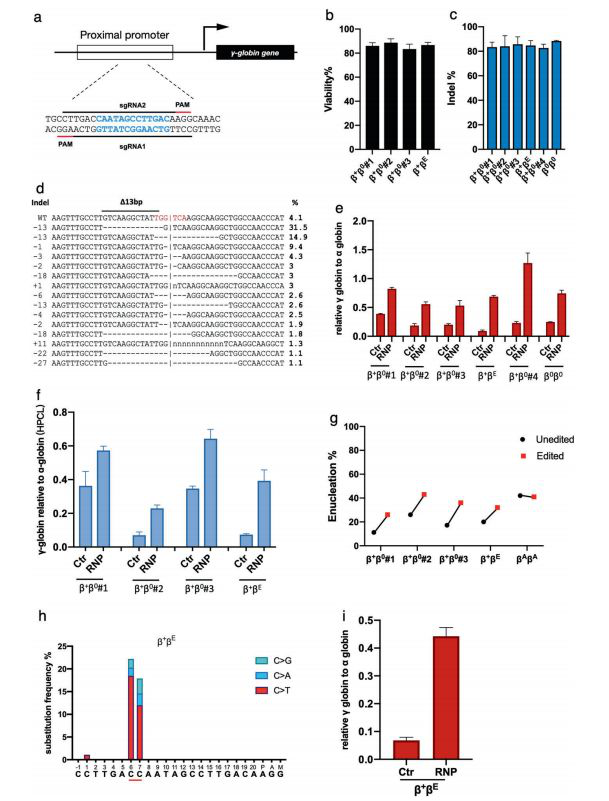
HBG1 / 2啟動子的基因組編輯可重新激活γ-珠蛋白的表達并改善β-地中海貧血癥
總之,研究通過Cas9:sgRNA和hA3A-BE3:sgRNA RN P電穿孔,證明了高效的HB G促進器編輯和γ-珠蛋白再激活β-地中海貧血患者衍生的HSPC,這表明了一種臨床上適用的治療β-血紅蛋白病的無選擇方法。理論上,HBG1/2啟動子的編輯不會影響其他基因,并且在安全性方面具有優勢,特別是在長期成人干細胞中。